Синдром церебральной гиперперфузии после проведения каротидной эндартерэктомии: клинический случай
Новиков О.В.1, Бердников П.В.1,2, Саскин В.А.1,2
- ФГБОУ ВО СГМУ (Архангельск) МЗ РФ
- ГБУЗ Архангельской области «Первая ГКБ им. Е.Е. Волосевич», Региональный сосудистый центр
Резюме: Синдром церебральной гиперерфузии (СЦГ) является редким, но серьезным осложнением оперативных вмешательств по реваскуляризации сонных артерий, включая каротидную эндартерэктомию и стентирование сонных артерий, а также может встречаться после лечения ишемического инсульта с помощью реперфузионных технологий. СЦГ характеризуется значительным увеличением мозгового кровотока, что может привести к широкому спектру клинических проявлений. Представленный случай описывает эпизод развития СЦГ у 65-летней женщины после каротидной эндартерэктомии, который проявился через два дня после операции и был осложнен развитием вазогенного отека головного мозга, судорогами и субарахноидальным кровоизлиянием неаневризматического генеза. Профилактика СЦГ включает строгий контроль артериального давления до, в ходе и после оперативного вмешательства. Однако алгоритм оказания помощи, так же, как и оптимальные показатели артериального давления для предупреждения СЦГ и лечения развившихся осложнений до сих пор не определены.
Ключевые слова: синдром церебральной гиперперфузии, вазогенный отек, каротидная эндартерэктомия, целенаправленное регулирование температуры.
Введение.
Синдром церебральной гиперерфузии (СЦГ) – редкое, но грозное осложнение после оперативных вмешательств по реваскуляризации сонных артерий, таких как каротидная эндартерэктомия (КЭАЭ) и стентирование сонных артерий (ССА). Кроме того, он может возникать при лечении ишемического инсульта с помощью реперфузионных технологий. СЦГ характеризуется выраженным увеличением мозгового кровотока (МК), что может привести к целому спектру клинических проявлений: ипсилатеральной головной боли, лицевой боли, общемозговому синдрому, эпилептическим приступам, очаговому неврологическому дефициту и внутричерепному кровоизлиянию. Пик заболеваемости СЦГ приходится на 12 часов после ССА и на 6 дней после КЭАЭ. Кроме того, после ССА значительно раньше после проведенной операции возникает внутричерепное кровоизлияние (ВЧК) (1,7±2,1 дня), чем после КЭАЭ (10,7±9,9 дня) (p=0,0098) [1].
Развитие СЦГ пытается объяснить несколько теорий – нарушение механизмов миогенной и нейрогенной ауторегуляции, повреждение свободными радикалами, нарушение барорецепторного рефлекса и тригеминоваскулярного рефлекса. Следствие одно – в результате действия патофизиологических механизмов происходит повышение МК. Потерявшие возможность к ауторегуляции сосуды оказываются неспособны справиться с большим потоком крови. Происходит нарушение целостности гематоэнцефалического барьера (ГЭБ), жидкость и белки проникают в ткань мозга. Возникает вазогенный отёк мозга, ведущий к разнообразным клиническим проявлениям [2].
Заболеваемость СЦГ после оперативных вмешательств по реваскуляризации сонных артерий составляет 1,16 % (диапазон 0.44–11.7 %) [3]. Частота встречаемости СЦГ варьирует из-за различий в дизайне исследований и определении заболевания [2].
Профилактика развития СЦГ направлена на строгий контроль артериального давления (АД) с учетом тяжести предшествующего стеноза в пред-, интра- и послеоперационном периоде. В настоящее время отсутствуют надёжные клинические данные, которые бы окончательно определили оптимальные показатели АД для снижения риска СЦГ. [4] Ввиду того, что хирургическая реканализация сонных артерий приобретает всё более широкое распространение, распознавание, наблюдение и лечение СЦГ становятся все более актуальными для снижения связанных с ним осложнений и смертности [4].
Данный клинический случай призван обратить внимание на это редкое и тяжёлое осложнение хирургической реваскуляризации и восстановления МК, а также показать возможные терапевтические опции в лечении.
Клинический случай.
Пациентка С. 65 лет поступила 22.01.2024 в стационар для проведения в плановом порядке КЭАЭ по поводу стеноза правой внутренней сонной артерии. По результатам предоперационного обследования стеноз правой внутренней сонной артерии составлял 81% с максимальной систолической скоростью кровотока 454 см/с. С противоположной стороны, в левой внутренней сонной артерии сужение не превышало 51% с максимальной систолической скоростью кровотока 103 см/с.
Из анамнеза было известно, что пациентка страдает мультифокальным атеросклерозом с преимущественным поражением брахиоцеребральных и коронарных артерий, гипертонической болезнью II стадии с высоким риском сердечно-сосудистых осложнений (рабочее АД 130/90 мм рт.ст.), а также хронической сердечной недостаточностью IIа стадии 3 функционального класса и дисциркуляторной энцефалопатией 2 стадии. Данных за перенесенное нарушение мозгового кровообращения в анамнезе нет. Пациентка принимала антигипертензивную терапию в виде комбинации эналаприла и индапамида.
Операция была успешно проведена 22.01.2024. Ранний послеоперационный период пациентка находилась под наблюдением в реанимационном отделении, осложнений не зарегистрировано. Через 2 суток (24.01.2024) в 16 часов у пациентки внезапно наросла общемозговая симптоматика, была многократная рвота. На момент осмотра дежурным врачом-неврологом сознание угнетено до уровня оглушения, контакт с больной невозможен, на вопросы не отвечает. В очаговом неврологическом статусе: ограничение движения глазных яблок по горизонтали в крайние отведения, левосторонний центральный прозопарез, левосторонний гемипарез со снижением силы до 3 баллов, положительный симптом Бабинского слева. Показатели гемодинамики: АД 150/90 мм рт.ст., частота сердечных сокращений (ЧСС) 72 уд/мин. С диагностической целью в срочном порядке выполнена рентгеновская компьютерная томография (РКТ) головного мозга (ГМ). Во время выполнения РКТ у пациентки развился генерализованный тонико-клонический судорожный приступ. По результатам РКТ ГМ поставлен диагноз субарахноидального кровоизлияния (САК) в правом полушарии ГМ с отёком коры лобной и теменной областей (рис.1). Пациентка была переведена в отделение реанимации и интенсивной терапии Регионального сосудистого центра.
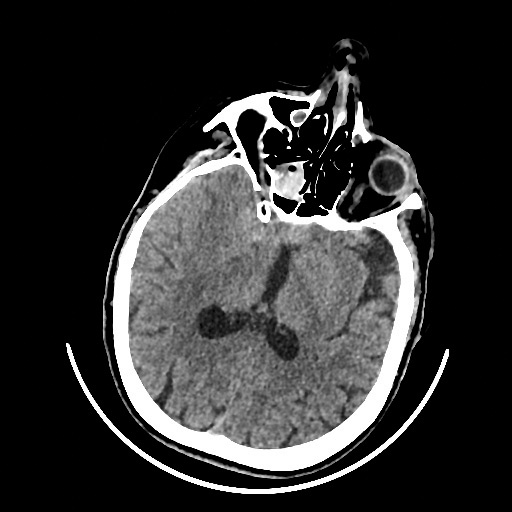
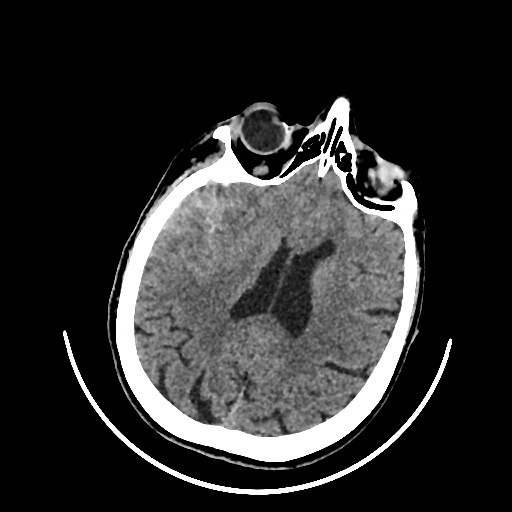
Рис.1 Рентгеновская компьютерная томография головного мозга от 24.01.2024
Примечание: На серии компьютерных томограмм справа в височно-лобно-теменной области определяется кровь в субарахноидальных пространствах. Вероятно, наличие крови по ходу основного ствола правой средней мозговой артерии. Значительный отёк, гиподенсивность коры в конвекситальных отделах правой лобной области. Лёгкая компрессия правого бокового желудочка без смещения срединных структур. Околостволовые цистерны прослеживаются. Костно-травматических изменений нет.
В течение 24.01.2024 – 25.01.2024 у пациентки наблюдались рецидивы генерализованных тонико-клонических судорожных приступов. В межприступный период общемозговая и очаговая симптоматика сохранялась на прежнем уровне. Гемодинамические показатели за этот временной период – отмечался разброс АД от 150/90 до 190/110 мм. рт. ст., ЧСС равнялась 60-70 уд/мин. С целью купирования судорожных приступов применялись бензодиазепины (дробные инъекции) и вальпроевая кислота. В связи с сохранением гипертензии и плохим ответом на антигипертензивную терапию с 28.01.2024 пациентке начата искусственная вентиляция легких.
Мероприятия интенсивной терапии включали в себя следующие направления:
Контроль показателей гемодинамики с удержанием АД на нижней оптимальной границе, в том числе с учетом данных Sbr O2 (требовалась агрессивная гипотензивная терапия – урапидил 9 мг/ч, азаметония бромид 0,2 мг/ч, с последующим переходом на энтеральное введение препаратов – эналаприл до 40 мг/сут., торасемид 10 мг/сут., нифедипин до 120 мг/сут., моксонидин до 1,2 мг/сут., лизиноприл до 40 мг/сут., доксазозин до 12 мг/сут.);
Седация и анальгезия (пропофол, фентанил);
Умеренная гипервентиляция с контролем капнометрии (EtCO2 30-32 мм рт.ст.);
Возвышенное положение головного конца 25-30°С.
Несмотря на вышеуказанные направления лечения на контрольной РКТ ГМ сохранялся вазогенный отек правого полушария с компрессией бокового желудочка и смещением срединных структур справа налево (рис. 2).
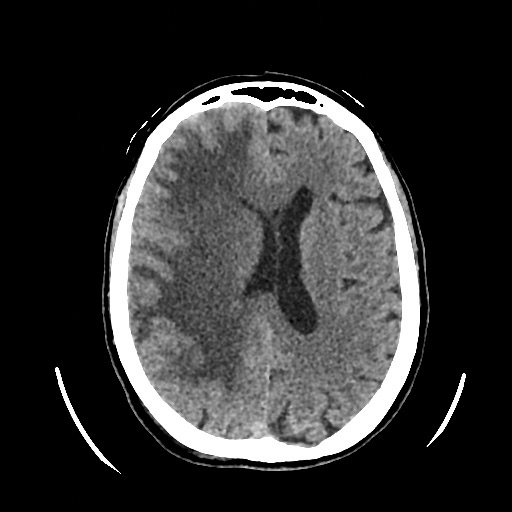
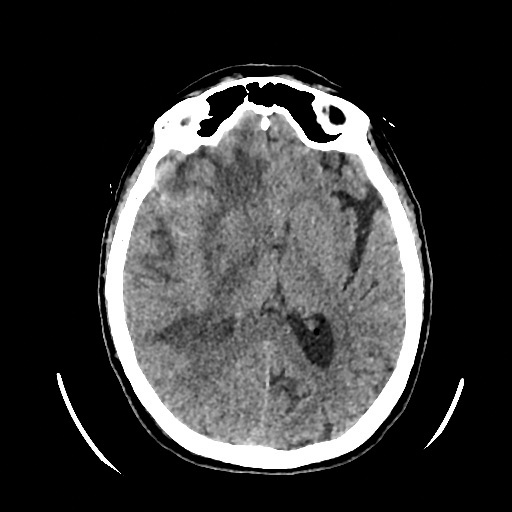
Рис.2. Рентгеновская компьютерная томография головного мозга от 02.02.2024
Примечание: По данным РКТ ГМ в правом полушарии сохраняется вазогенный отек, практически в прежнем объеме. В субарахноидальном пространстве правого полушария сохраняется кровь. Срединные структуры мозга смещены влево до 0.5 см. Боковые желудочки асимметричны, правый – компремирован. Сохраняется небольшое количество крови в задних рогах боковых желудочков, преимущественно в левом. Диаметр зрительного нерва справа 0.52 см и слева до 0.6 см.
После получения результатов нейровизуализации было принято решение об оптимизации интенсивной терапии за счет мероприятий целенаправленного регулирования температурного баланса (ЦРТ) у пациентки в критическом состоянии. В течение последующих 7 суток пациентке проводилась неинвазивная терапевтическая гипотермия. Нами использовано устройство терморегулирующее медицинское «Гипотерм» (ООО «Торговый Дом МедМос») в модификации ZLJ-2000I с комплектующими – мягкий терморегулирующий шлем, 2 терморегулирующих одеяла. Во время использования терморегулирующие шлем и одеяла были размещены в один слой соответственно положению пациента (одно одеяло было размещено под пациентом, второе сверху). Измерение температуры тела пациента проводилось в эзофагеальной позиции. Диапазон температуры охлаждения циркулирующей жидкости установлен в диапазоне 9-11 °С. Время выхода устройства на режим эффективной гипотермии составило около 30 минут. Удалось достичь и поддерживать заданную аппаратом температуру тела пациентки в пределах 35.5-36,5 °C (рис. 3)
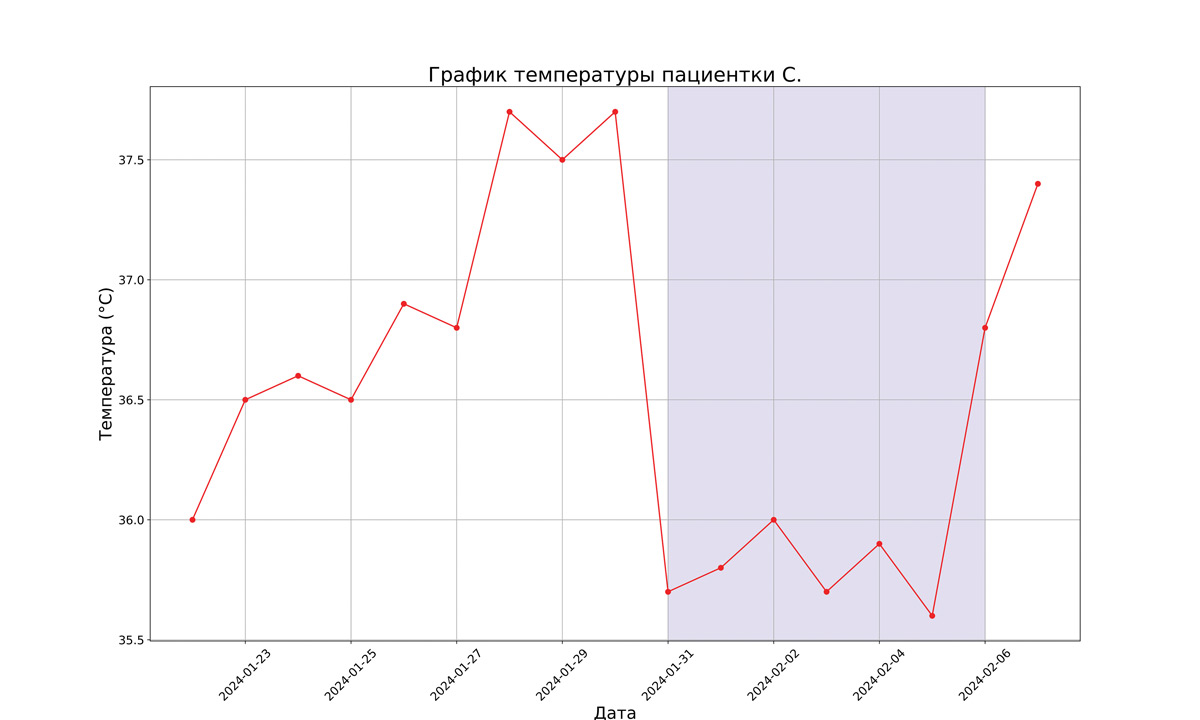
Рис.3. График температуры пациентки С.
Примечание: закрашенная голубым зона обозначает период проведения мероприятий ЦРТ.
При контрольной нейровизуализации (рис. 4) отмечается положительная динамике в виде значимого уменьшения вазогенного отека ГМ, уменьшения смещения срединных структур и восстановления формы правого бокового желудочка. Мероприятия ЦРТ были прекращены.
В дальнейшем период пребывания в ОРИТ РСЦ осложнился присоединением у пациентки гнойно-инфекционных осложнений – двусторонняя нозокомиальная полисегментарная пневмония, инфекция области операционной раны КЭАЭ, инфицирование кровотока с септическим шоком. Летальный исход произошел на 42 сутки в связи с состоявшимся острым мезентериальным тромбозом.
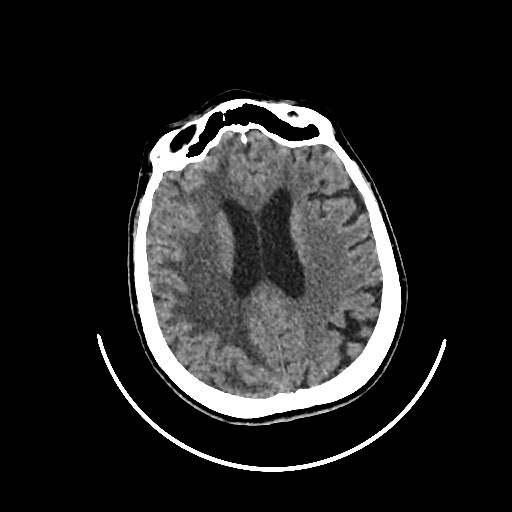
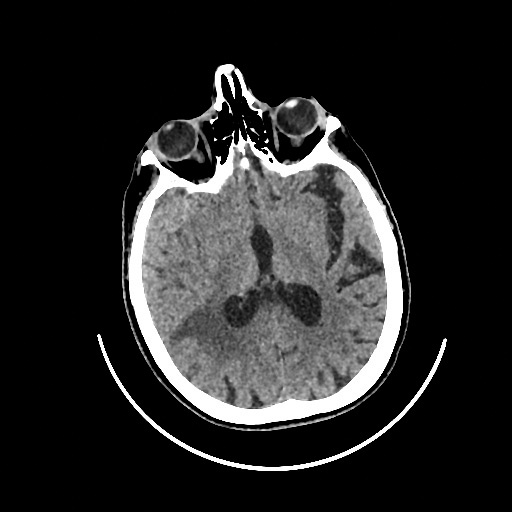
Рис. 4. Рентгеновская компьютерная томография головного мозга от 07.02.2024
Примечание: сохраняется гиподенсивность белого вещества правого полушария ГМ. Правый боковой желудочек почти полностью расправился. Сохраняется кровь в бороздах лобно-теменной области правого полушария ГМ.
Обсуждение.
В представленном нами клиническом примере у пациентки имелось большое число факторов риска развития СЦГ: стеноз оперируемой сонной артерии высокой степени, гемодинамически значимый стеноз контралатеральной артерии, гипертоническая болезнь и женский пол [9].
Интраоперационный период КЭАЭ прошел без осложнений. В раннем периоде наблюдения пациентка успешно преодолела первый (12-часовой) пик заболеваемости СЦГ. По данным мета-анализа Bouri S. et al. уровень систолического АД превышающий 150 мм рт.ст. ведёт к росту заболеваемости СЦГ [6]. Предшествующие факторы риска в совокупности с недостаточным послеоперационным контролем АД, скорее всего, привели к развитию СЦГ, который клинически манифестировал нарушением сознания, гемиплегией и эпилептическим приступом. По данным нейровизуализации диагностировано типичное проявление СЦГ – вазогенный отёк ГМ, а также более редкое осложнение, которое встречается менее 5 % случаев, – САК [7]. Обращает на себя внимание раннее (2-сутки) возникновение последнего у нашей пациентки. По данным Ogasawara K. et al. среднее время возникновения САК после КЭАЭ составляет 10-11 суток [12]. В настоящее время методы, позволяющие предсказать и предупредить возникновение СЦГ у пациентов после реваскуляризации сонных артерий, не разработаны.
В контексте развития СЦГ и связанного с ним отека мозга важно принимать во внимание комплексный подход к лечению, который включает в себя как медикаментозные, так и нефармакологические методы. Основной целью лечения является минимизация дальнейшего ишемического повреждения головного мозга и предотвращение осложнений.
Один из первых шагов в лечении СЦГ – строгий контроль параметров гемодинамики. Рекомендуется поддержание целевых уровней систолического АД менее 150 мм. рт.ст. для снижения перфузионного давления и предотвращения прогрессирования вазогенного отёка. Использование антигипертензивных препаратов, таких как ингибиторы ангиотензин превращающего фермента, бета-блокаторы или кальциевые антагонисты, должно быть индивидуализировано в зависимости от тяжести предшествующей артериальной гипертензии, общего состояния пациента и наличия сопутствующих заболеваний.
В качестве мер по снижения внутричерепного давления и борьбы с отеком ГМ рекомендовано поддержание эуволемии с осмоляльностью плазмы от 295 до 305 мОсмоль/л. Для достижения нужной осмоляльности и коррекции гиперволемии могут применяться осмотические диуретики, например, маннитол. Гипертонический раствор натрия хлорида может быстро и эффективно снижать внутричерепное давление (ВЧД). Оба препарата показывают эффективность в том числе при лечении отёка, возникающего при состояниях с нарушением ГЭБ [14]. Применение требует тщательного мониторинга, ввиду опасности развития понтинной или экстрапонтинной демиелинизации. По результатам нескольких мета-анализов, оба раствора показали примерно одинаковое влияние на внутричерепную гипертензию и исходы пациентов. [15, 16]. Однако следует отметить, что до сих пор нет данных, свидетельствующих об эффективности и безопасности применения гипертонических растворов и маннитола у пациентов с СЦГ [17].
Гипервентиляция под контролем капнометрии – ещё один метод в терапии пациентов с отеком ГМ, особенно эффективный для быстрого снижения повышенного ВЧД. Вызывая контролируемое снижение уровня углекислого газа в крови (PaCO2) за счет увеличения скорости вентиляции, гипервентиляция приводит к рефлекторному сужению сосудов ГМ, эффективно уменьшая объем МК и тем самым снижая ВЧД. Капнометрия обеспечивает мониторинг в режиме реального времени, гарантируя, что корректировка PaCO2 производится в безопасных пределах – обычно между 30 и 35 мм рт.ст. [14,18].
Для уменьшения метаболических потребностей ГМ и снятия симпатического ответа в виде гипертензии и тахикардии показано использование медикаментозной седации [19, 20]. Наиболее подходящим препаратом является пропофол, поскольку он легко поддается титрованию и имеет короткий период полувыведения, что позволяет проводить оценку динамики неврологического статуса. Кроме того, появляется все больше данных, о более прямом влиянии пропофола на отек ГМ через модуляцию активности белка аквапорина-4 [21, 22]. Мидазолам, фентанил, дексмедетомидин также могут способствовать снижению ВЧД, воздействуя на метаболические потребности ГМ и болевую чувствительность. Дополнительным эффектом от введения данных препаратов является снижение общего периферического сопротивления [23].
В последние годы обсуждается роль ЦРТ в лечении отека ГМ, вызванного СЦГ. Гипотермия, как метод снижения температуры тела и мозга, может снизить метаболические процессы в ГМ, уменьшить потребность в кислороде и, как следствие, уменьшить отек ГМ. Исследования показали, что контролируемая гипотермия может быть эффективна в снижении ВЧД и улучшении исходов у пациентов с тяжелым отеком мозга. Однако, применение этого метода требует тщательного мониторинга и контроля, поскольку существует риск развития вторичных осложнений, связанных с гипотермией, таких как инфекционные процессы, коагулопатии и сердечно-сосудистые нарушения [24].
В конечном итоге, выбор тактики лечения должен опираться на индивидуальные особенности пациента, сопутствующие заболевания и учитывать все имеющиеся факторы риска. Междисциплинарная бригада врачей, включающая неврологов, терапевтов и реаниматологов, должна тесно сотрудничать для разработки наиболее эффективного плана лечения.
Тяжелые последствия и высокая летальность данного осложнения требуют тщательного наблюдения в послеоперационном периоде для своевременной диагностики и предупреждения развития жизнеугрожающих состояний. Кроме того, все пациенты, подвергающиеся вмешательствам с целью реваскуляризации сонных артерий, нуждаются в регулярном мониторировании АД и неврологического статуса в послеоперационном периоде.
Заключение.
Приведенный клинический случай подчеркивает серьезность и одновременно сложность терапии СЦГ в послеоперационном периоде после реваскуляризации сонных артерий, в связи с отсутствием четких рекомендаций по профилактике и управлению СЦГ.
Несмотря на редкость возникновения СЦГ, его жизнеугрожающие осложнения требуют повышенного внимания к факторам риска, мониторингу АД и неврологического статуса пациентов в пери- и послеоперационном периоде. В качестве дополнительной опции к базисной терапии отека головного мозга необходимо рассматривать методику ЦРТ. Для получения большего эффекта от повышения агрессивности лечения требуется раннее распознавание возможных осложнений реваскуляризации сонных артерий, в том числе на основе расширенного мониторинга.
Список литературы:
- Ogasawara K., Sakai N., Kuroiwa T. et al. Japanese Society for Treatment at Neck in Cerebrovascular Disease Study Group. Intracranial hemorrhage associated with cerebral hyperperfusion syndrome following carotid endarterectomy and carotid artery stenting: retrospective review of 4494 patients. J Neurosurg. 2007 Dec;107(6):1130-6. doi: 10.3171/JNS-07/12/1130. PMID: 18077950.
- Kirchoff-Torres K.F., Bakradze E.. Cerebral Hyperperfusion Syndrome After Carotid Revascularization and Acute Ischemic Stroke. Curr Pain Headache Rep. 2018 Mar 19;22(4):24. doi: 10.1007/s11916-018-0678-4. PMID: 29556806.
- Lin Y.H., Liu H.M. Update on cerebral hyperperfusion syndrome. J Neurointerv Surg. 2020 Aug;12(8):788-793. doi: 10.1136/neurintsurg-2019-015621. Epub 2020 May 15. PMID: 32414892; PMCID: PMC7402457.
- Moulakakis K.G., Mylonas S.N., Sfyroeras G.S., Andrikopoulos V. Hyperperfusion syndrome after carotid revascularization. J Vasc Surg. 2009 Apr;49(4):1060-8. doi: 10.1016/j.jvs.2008.11.026. Epub 2009 Feb 26. PMID: 19249185.
- González García A., Moniche F., Escudero-Martínez I. et al. Clinical Predictors of Hyperperfusion Syndrome Following Carotid Stenting: Results From a National Prospective Multicenter Study. JACC Cardiovasc Interv. 2019 May 13;12(9):873-882. doi: 10.1016/j.jcin.2019.01.247. PMID: 31072509.v
- Bouri S., Thapar A., Shalhoub J. et al. Hypertension and the post-carotid endarterectomy cerebral hyperperfusion syndrome. Eur J Vasc Endovasc Surg. 2011 Feb;41(2):229-37. doi: 10.1016/j.ejvs.2010.10.016. Epub 2010 Dec 4. PMID: 21131217.
- Pan J., Konstas A.A., Bateman B. et al. Reperfusion injury following cerebral ischemia: pathophysiology, MR imaging, and potential therapies. Neuroradiology. 2007 Feb;49(2):93-102. doi: 10.1007/s00234-006-0183-z. Epub 2006 Dec 20. PMID: 17177065; PMCID: PMC1786189.
- Abou-Chebl A., Yadav J.S., Reginelli J.P. et al. Intracranial hemorrhage and hyperperfusion syndrome following carotid artery stenting: risk factors, prevention, and treatment. J Am Coll Cardiol. 2004 May 5;43(9):1596-601. doi: 10.1016/j.jacc.2003.12.039. PMID: 15120817.
- Galyfos G., Sianou A., Filis K. Cerebral hyperperfusion syndrome and intracranial hemorrhage after carotid endarterectomy or carotid stenting: A meta-analysis. J Neurol Sci. 2017 Oct 15;381:74-82. doi: 10.1016/j.jns.2017.08.020. Epub 2017 Aug 18. PMID: 28991720.
- Dua A., Romanelli M., Upchurch G.R. et al. Predictors of poor outcome after carotid intervention. J Vasc Surg. 2016 Sep;64(3):663-70. doi: 10.1016/j.jvs.2016.03.428. Epub 2016 May 18. PMID: 27209401.
- Hashimoto T., Matsumoto S., Ando M. et al. Cerebral Hyperperfusion Syndrome After Endovascular Reperfusion Therapy in a Patient with Acute Internal Carotid Artery and Middle Cerebral Artery Occlusions. World Neurosurg. 2018 Feb;110:145-151. doi: 10.1016/j.wneu.2017.11.023. Epub 2017 Nov 14. PMID: 29146434.
- Ogasawara K., Konno H., Yukawa H. et al. Transcranial regional cerebral oxygen saturation monitoring during carotid endarterectomy as a predictor of postoperative hyperperfusion. Neurosurgery. 2003 Aug;53(2):309-14; discussion 314-5. doi: 10.1227/01.neu.0000073547.86747.f3. PMID: 12925245.
- Iwata T., Mori T., Tajiri H., Nakazaki M. Predictors of hyperperfusion syndrome before and immediately after carotid artery stenting in single-photon emission computed tomography and transcranial color-coded real-time sonography studies. Neurosurgery. 2011 Mar;68(3):649-55; discussion 655-6. doi: 10.1227/NEU.0b013e3182077ed8. PMID: 21311294.
- Cook A.M., Morgan Jones G., Hawryluk G.W.J, et al. Guidelines for the Acute Treatment of Cerebral Edema in Neurocritical Care Patients. Neurocrit Care. 2020 Jun;32(3):647-666. doi: 10.1007/s12028-020-00959-7. PMID: 32227294; PMCID: PMC7272487.
- Kamel H., Navi B.B., Nakagawa K. et al. Hypertonic saline versus mannitol for the treatment of elevated intracranial pressure: a meta-analysis of randomized clinical trials. Crit Care Med. 2011 Mar;39(3):554-9. doi: 10.1097/CCM.0b013e318206b9be. PMID: 21242790.
- Mortazavi M.M., Romeo A.K., Deep A. et al. Hypertonic saline for treating raised intracranial pressure: literature review with meta-analysis. J Neurosurg. 2012 Jan;116(1):210-21. doi: 10.3171/2011.7.JNS102142. Epub 2011 Sep 23. PMID: 21942722.
- van Mook WN, Rennenberg RJ, Schurink GW, van Oostenbrugge RJ, Mess WH, Hofman PA, de Leeuw PW. Cerebral hyperperfusion syndrome. Lancet Neurol. 2005 Dec;4(12):877-88. doi: 10.1016/S1474-4422(05)70251-9. PMID: 16297845.
- Heffner J.E., Sahn S.A. Controlled hyperventilation in patients with intracranial hypertension. Application and management. Arch Intern Med. 1983 Apr;143(4):765-9. PMID: 6404229.
- Lassen N.A., Christensen M.S. Physiology of cerebral blood flow. Br J Anaesth. 1976 Aug;48(8):719-34. doi: 10.1093/bja/48.8.719. PMID: 7284.
- Halstead M.R., Geocadin R.G. The Medical Management of Cerebral Edema: Past, Present, and Future Therapies. Neurotherapeutics. 2019 Oct;16(4):1133-1148. doi: 10.1007/s13311-019-00779-4. PMID: 31512062; PMCID: PMC6985348.
- Zheng Y.Y., Lan Y.P., Tang H.F., Zhu S.M. Propofol pretreatment attenuates aquaporin-4 over-expression and alleviates cerebral edema after transient focal brain ischemia reperfusion in rats. Anesth Analg. 2008;107(6):2009–2016.
- Ding Z., Zhang J., Xu J. et al. Propofol administration modulates AQP-4 expression and brain edema after traumatic brain injury. Cell Biochem Biophys. 2013;67(2):615–622.
- Alnemari A.M., Krafcik B.M., Mansour T.R., Gaudin D. A comparison of pharmacologic therapeutic agents used for the reduction of intracranial pressure after traumatic brain injury. World Neurosurg. 2017;106:509–528.
- Choi H.A., Badjatia N., Mayer S.A. Hypothermia for acute brain injury--mechanisms and practical aspects. Nat Rev Neurol. 2012 Feb 28;8(4):214-22. doi: 10.1038/nrneurol.2012.21. PMID: 22371279.

